通用CAR |
您所在的位置:网站首页 › 人人都能学懂car t › 通用CAR |
通用CAR
|
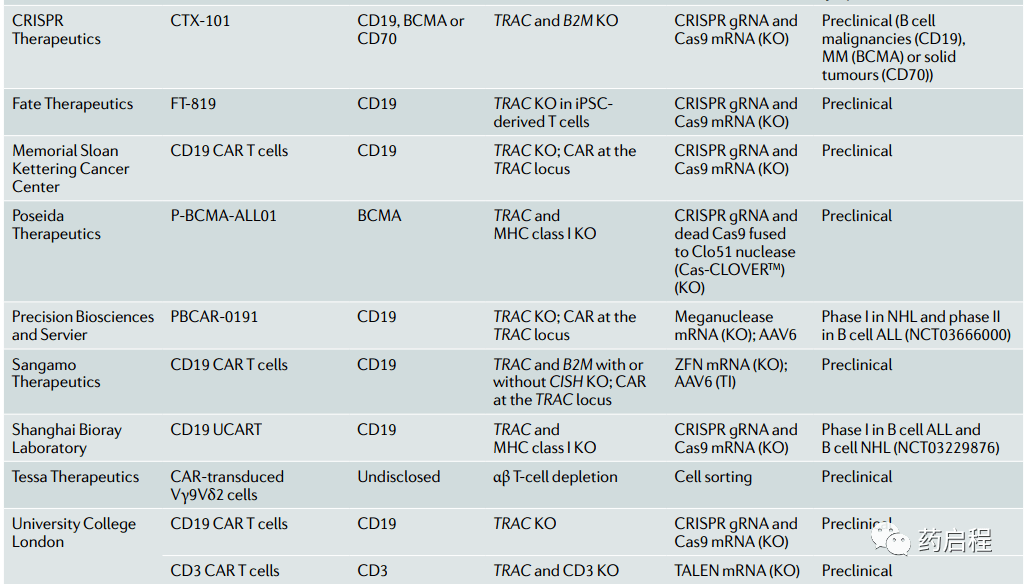
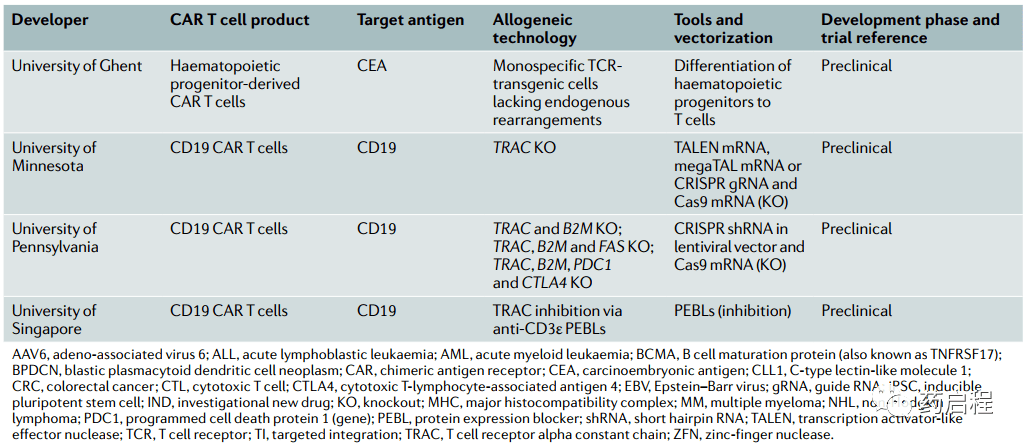
使用非αβT细胞 第二种方法包括完全避免使用αβ T细胞并设计另一种细胞类型来携带CAR。理论上,适合CAR过继治疗的细胞类型必须具有可通过细胞表面受体重新定向的细胞毒性特性,必须可从PBMC或可再生干细胞等可获得的来源获得,并且必须相对容易转导和扩增。NK细胞最初被鉴定为具有杀死肿瘤细胞的能力,是生物体天然肿瘤免疫监视的一个组成部分。NK细胞对表现出激活受体与抑制受体的适当平衡的细胞具有高度溶细胞性。 几项研究表明,不同类型癌症中的NK细胞功能障碍,说明癌症已经进化出逃避NK细胞杀伤的机制。因此,通过为NK细胞提供CAR来增强其抗肿瘤活性是一种有吸引力的策略。 Chu等人证明,用CAR构建体转导NK细胞系可增强NK细胞在体外和异种肿瘤移植物中的抗肿瘤活性。在另一项研究中,来自健康供体的NK细胞系和原代NK细胞转导了针对表皮生长因子受体(EGFR)的CAR和 EGFRvIII变体(常见于胶质母细胞瘤中),显示出对胶质母细胞瘤细胞系和患者来源的活性胶质母细胞瘤干细胞。 外周血中NK细胞浓度相对较低,这引发了制定策略以在体外特异性富集和扩增它们。例如,NK92细胞系已被批准用于人类,并且在使用重组IL-2在良好生产实践条件下扩增后将构成CAR NK细胞的可再生来源。其他方法包括输注后UCB衍生的CAR NK细胞的扩增和/或存活,例如通过表达IL-15和CAR38。 与CD19 CAR NK细胞对照相比,该策略证明了使用CD19 CAR-IL-15转导的NK细胞在淋巴瘤异种移植小鼠模型中的存活时间延长。 在临床前模型中,用CD19定向CAR改造的iNKT细胞通过靶向表达在淋巴瘤细胞上的CD19和CD1d具有很强的抗淋巴瘤特性。鉴于同种异体iNKT细胞对GVHD的保护作用,CAR iNKT细胞可能是一个有趣的现成开发群体。潜在的限制是这些细胞的缺乏,这将需要大规模的离体扩增。 另一个候选者是γδ T细胞,它们自然也能够对肿瘤细胞产生细胞毒性反应。γδ T细胞仅占循环淋巴细胞的1-5%,但主要存在于一些上皮部位,如肠道、生殖器官、舌头和皮肤。它们的组织驻留模式使它们成为过继治疗的有吸引力的候选者,因为αβ T细胞的一个潜在限制是它们难以接触到非炎症性肿瘤。离体,γδ T细胞可以扩大到大量。它们不太可能诱发GVHD,因为它们的TCR的激活不受MHC限制。针对二唾液酸神经节苷脂GD2的CARγδ T细胞增强了对GD2表达细胞系的细胞毒性,该细胞经常在神经胶质瘤和其他神经外胚层来源的肿瘤中过度表达。 使用基因编辑 最后,还有αβTCR缺失的方法。由于αβ TCR是T细胞同种异体反应的决定因素,研究人员已经开发出方法来防止功能性TCR在αβ T细胞表面表达。基因编辑是当今最有前途的此类方法之一。由于开创性的工作显示了归巢核酸内切酶I-SceI在哺乳动物细胞中诱导定点染色体重组的功效,因此出现了一系列基因编辑工具(框 1)。 这些工具的共同目标是通过将嵌合核酸酶引入细胞核,同时尽可能避免脱靶切割,在预选位置产生特定的DNA双链断裂。一旦发生DNA断裂,细胞DNA修复机制将通过容易出错的非同源末端连接途径导致基因失活(基因敲除)或通过同源重组途径导致基因插入或校正(基因敲入),前提是外源DNA修复模板可用。 TCR蛋白复合物由一条α链和一条β链(在αβ Τ细胞中)或一条γ链和一条δ链(在γδ T细胞中)组成,与CD3蛋白等辅助分子结合。β链基因包含两个可能的恒定区,而编码α链的基因只有一个。因此,破坏编码 T 细胞受体恒定α链(TRAC)的基因是破坏αβ TCR 的最直接方法。 第一项评估在CAR T细胞中敲除TRAC可行性的报告研究发表于 2012 年。与之前的报告表明TCR的存在是最佳CAR功能所必需的,报告作者表明,通过锌指技术(框 1)消除TCR表达并没有损害CD19特异性 CAR 的抗肿瘤特性T细胞。 这些研究人员表明,通过同时将靶向TRAC和CD52的TALEN电穿孔到T细胞中,可以有效地实现多重基因编辑。由此产生的TCR 缺陷和CD52缺陷供体T细胞在小鼠模型中不会诱导GVHD,并且对抗CD52单克隆抗体 alemtuzumab 具有抗性,该抗体可用于消除宿主T细胞(表达 CD52)并避免同种异体排斥。最近,还开发了megaTAL核酸酶和工程化的I-CreI归巢核酸内切酶,以有效破坏内源性TCR。 此外,Ren等人最近使用 CRISPR 系统生成含有两到四个被破坏基因的同种异体通用CAR T细胞。然而,这种技术性能伴随着未知的风险,因为在多个位置同时切割DNA可能会产生多个易位,并且目前似乎不适用于治疗产品。同样,必须尽可能避免脱靶切割,因为它可能引发不利影响,例如不需要的基因失活或重排,这可能反过来导致增殖和生存优势,正如Fraietta等人所报道的。然而,同种异体CAR T细胞的这种风险似乎很低,因为从第三方供体产生的通用同种异体CAR T细胞本质上必然会被宿主免疫系统根除。这与自体CAR T细胞不同,自体CAR T细胞在某些情况下可能持续数年。最近的一项研究利用TCR基因敲除来产生抗自相残杀(彼此之间不发生交叉反应)CD3特异性CAR T细胞来治疗 T 细胞ALL。 基因编辑步骤之后或之前是病毒载体转导后随机整合的CAR。通过利用细胞同源重组途径,Eyquem 等人开发了一种将CAR结构纳入TRAC基因座的策略。CRISPR-Cas9技术与携带CAR结构的腺病毒相关病毒载体一起使用,该载体两侧有两个与切割位点同源的臂,将编码CAR的 DNA直接插入TRAC基因座。 与逆转录病毒转导后CAR的随机整合相比,这种有针对性的整合方法提供了几个潜在的优势。首先,TCR与CAR的引入同时失活。其次,它可能是一种更安全的方法,因为消除了与插入诱变相关的潜在不利影响。最后,CAR表达由内源性TCR启动子调节,在暴露于抗原时模拟 TCR转录,并防止可能导致T细胞分化和衰竭的持续过度T细胞活化。结果,Eyquem 等人表明TRAC-CD19 CAR T细胞在ALL小鼠模型中表现出比具有逆转录病毒编码的CAR T细胞更强的抗肿瘤效力。 类似地,megaTAL核酸酶和工程归巢核酸内切酶也用于使用相同的策略将CAR cDNA引入TRAC基因座。用这个过程产生的CD19 CAR T细胞在B细胞淋巴瘤小鼠模型中也很有效。 通过TALEN介导的TRAC基因编辑产生的CAR T细胞的首次临床试验正在进行中。大约80%的这些细胞在基因编辑后在表面不表达αβ TCR,剩余的αβ TCR阳性细胞在储存前被磁性去除,使用抗αβ TCR抗体和已开发的GMP兼容自动化系统在SCT的背景下,去除T细胞有助于降低GVHD的发生率。在使用这些细胞的体内模型中没有观察到GVHD的迹象。 两名ALL儿科患者使用同种异体CD19 CAR T细胞(UCART19)作为移植的桥梁,显示了概念的临床证明。两名患者均达到完全缓解,最小残留病(MRD)阴性,无明显GVHD。 正在进行两项I/II期临床试验,以评估 UCART19在成人和儿童ALL中的疗效。在儿科试验中,6名入组患者中有5名在第28天达到完全缓解或完全缓解但血液学恢复不完全且MRD为阴性,并按照方案中的计划进行具有治愈目的的异基因SCT。2名患者1年后仍处于缓解期。在成人试验中,10名可评估患者中有8名达到完全缓解或完全缓解但血液学恢复不完全。值得注意的是,两名患者接受了第二剂UCART19(方案外),并在第二剂后第28天实现了MRD阴性完全缓解或血液学不完全恢复的完全缓解。六名患者进行同种异体SCT。迄今为止,在所有接受治疗的患者中均未观察到明显的GVHD。这些初步的临床结果令人鼓舞,并表明同种异体CAR T细胞可以在患者体内扩增。然而,需要更多的患者和更长的随访时间才能与使用自体CD19 CAR T细胞获得的结果进行比较。一个主要问题是不接受同种异体SCT的患者的反应持续时间。 框 1 用于精确基因编辑的主要核酸酶 一个控制RVD核苷酸特异性的简单“代码”已被破译,这简化了 TALEN 的设计。通常,TALEN旨在结合由两个16个核苷酸序列组成的 DNA靶标,该序列由15-16个核苷酸的间隔序列隔开。TALENs的一个显着特征是在每个靶序列(T0)的5'末端存在一个胸腺嘧啶,这有利于高效切割。通过将TALE结构域与源自归巢核酸内切酶(HE) I-TevI的序列特异性催化结构域融合开发了单体TALEN结构,从而产生了Tev-TALE单体核酸酶。 MegaTAL是源自HEs的单体人工嵌合核酸酶。HEs可以被设计为靶向基因组中的特定序列。然而,这个过程极具挑战性,需要很多专业知识。为了增加megaTALs的亲和力和特异性,将一个短的TALE域融合到 HE。少至 5.5个TALE重复就可以增加megaTAL活性。与Tev-TALE核酸酶相似,megaTAL产生3'-突出的DNA末端,这被认为有利于同源重组。 成簇的规则间隔短回文重复(CRISPR)系统源自微生物适应性免疫系统。该系统是核酸酶和短RNA的组合。与上述核酸酶的特异性依赖于蛋白质-DNA相互作用不同,CRISPR系统的特异性与互补的RNA-DNA碱基配对有关。一种称为“单向导RNA”(sgRNA)的20个核苷酸的RNA旨在与基因组 DNA 靶标互补。然而,部分错配是可以容忍的,这可能会增加脱靶切割的可能性。当今最常用的CRISPR系统源自化脓性链球菌并使用核酸酶 Cas9。一个 20个核苷酸的靶序列(NGG)将Cas9 引导至靶位点。与ZFNs、TALENs 和 MegaTALs 相比,Cas9的切割产生平端DNA末端。最近,一种名为“CRISPR-Cpf1”的新CRISPR系统被描述为具有高度特异性。 参考来源:‘Off-the-shelf’ allogeneic CAR T cells: development and challenges
在此背景下,生物制品圈联合四叶草会展策划组织第二届细胞和基因治疗技术论坛,邀请国内外业界嘉宾共同讨论细胞免疫和基因治疗当前面临的挑战以及突破思路,将围绕细胞免疫、基因治疗、溶瘤病毒药物的创新研究、工艺开发、生产质控、临床、注册、产业化等方面进行深入的分享和交流。 时间:2022年6月11-12日 地点:上海 (酒店定向通知) 规模:500-600人 主办单位:四叶草会展、生物制品圈 协办单位:香港奥星集团 媒体支持:药时空、抗体圈、药创客 会议费用:为细胞和基因治疗领域研发人员提供参会福利,3月31日之前报名FREE!(仅收取50元定金,含茶歇、会议资料等,定金概不退还)(如需用餐,2天午餐加收150元),先到先得,报完即止,3月31日以后报名将收取会议费!请提前锁定! 报名方式:扫描下方二维码 → 填写表格 → 报名成功(报名志愿者, 免交定金,承担一定工作任务)! 组委会获得报名信息后,根据报名信息进行初筛,并进一步与报名者沟通确认,实现精准邀请。最终有机会进入大会微信群(严格审核通过)。 主要议题和内容
已经确定的报告人介绍
更多报告人正在邀请中,以最终版日程为准 点击即可查看往期日程 请注明:姓名+研究方向! 版 权 声 明 本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系([email protected]),我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |